
Inhalt
- Stufen
- Methode 1 Eine Gleichung nach der Trial-and-Error-Methode ausgleichen
- Methode 2 Equilibrieren Sie eine Gleichung mit der algebraischen Methode
In der Chemie legt eine Gleichung fest, was während einer chemischen Reaktion passiert ist. Links von der Gleichung platzieren wir die Reagenzien, die für das Experiment verwendet wurden, und rechts die Produkte, die während des Experiments erhalten wurden. Nach dem Prinzip der Erhaltung der Masse (Lavoisier) bei einer chemischen Reaktion verschwindet kein Atom, es entsteht kein Atom, sie verbinden sich unterschiedlich. Zusammenfassend muss für jedes Element rechts und links von der Gleichung die gleiche Anzahl von Datomen angegeben werden. Deshalb muss eine Gleichgewichtsgleichung immer ausgeglichen sein.
Stufen
Methode 1 Eine Gleichung nach der Trial-and-Error-Methode ausgleichen
-
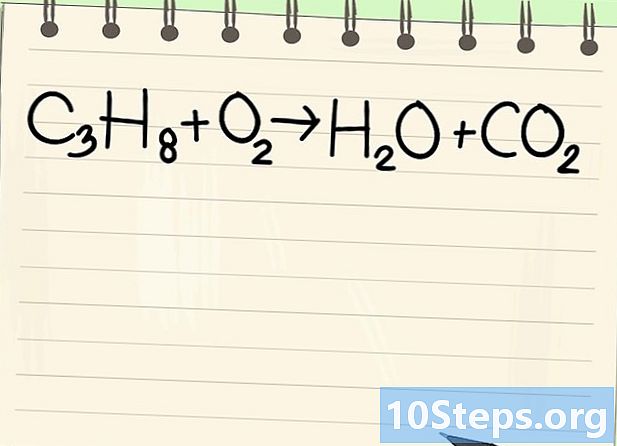
Beachten Sie die Bilanzgleichung. Wir werden die folgende Gleichung behandeln:- C3H8 + O2 -> H2O + CO2
- Dies ist die Gleichung der Propanverbrennung (C3H8) in Sauerstoff: Wasser und Kohlendioxid werden erhalten.
-
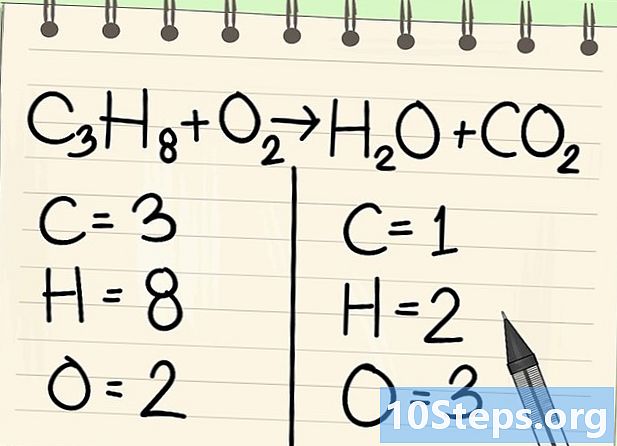
Zähle die Atome. Geben Sie die Anzahl der Daten jedes Elements auf einer Seite der Gleichung und dann auf der anderen ein. Berücksichtigen Sie dazu die Indizes, wenn es keine gibt, ist der Index 1.- Auf der linken Seite befinden sich 3 Kohlenstoffatome, 8 Wasserstoff und 2 Sauerstoff.
- Rechts gibt es 1 Atom Kohlenstoff, 2 Atom Wasserstoff und 3 Atom Sauerstoff.
-
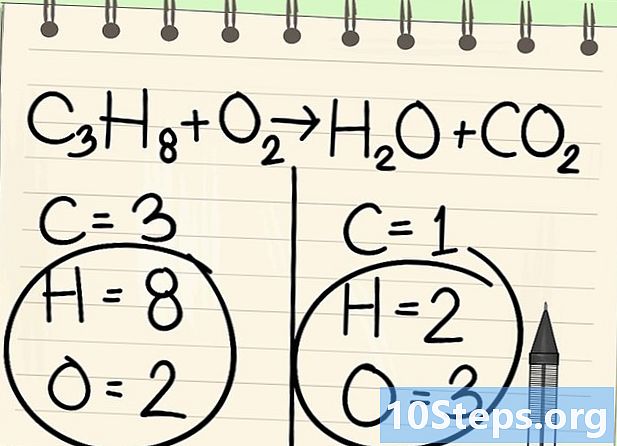
Lassen Sie den Wasserstoff und den Sauerstoff kurz beiseite. -

Fange an, mit dem richtigen Element zu balancieren. Wir beginnen immer mit dem Molekül vor und nach der Reaktion. Wenn es mehrere gibt, nimm das, das in einem der Moleküle einwertig ist. Hier beginnen wir mit den Kohlenstoffatomen. -

Gleichen Sie die Kohlenstoffatome aus. Addiere rechts einen Koeffizienten zum Kohlendioxidmolekül (CO2) in dem das Kohlenstoff-Latom alleine ist. Wir werden eine 3 setzen, um die 3 linken Atome zu erhalten.- C3H8 + O2 -> H2O + 3CO2
- Wir haben also 3 Kohlenstoffatome auf der rechten Seite dank des Koeffizienten (3CO2) und 3 Kohlenstoffatomen links dank Index (C3H8).
- In eine Gleichung können Sie alle gewünschten Koeffizienten einfügen, aber Sie können die Hinweise nicht berühren.
-
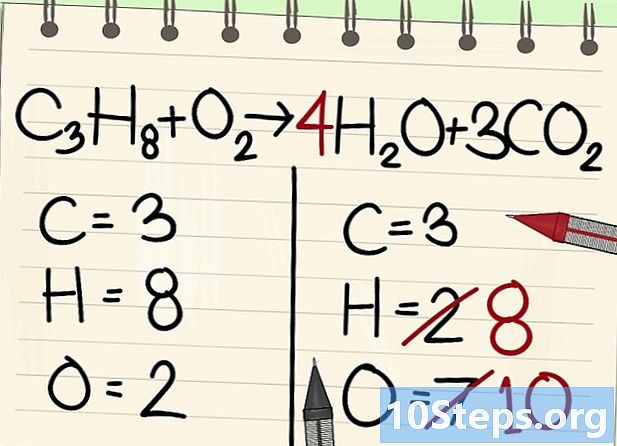
Gleichen Sie die Wasserstoffatome aus. Da Sie 8 links von der Gleichung haben, brauchen Sie so viel rechts.- C3H8 + O2 --> 4H2O + 3CO2
- Rechts geben Sie einen Koeffizienten von 4 an, da der Wasserstoff im Wassermolekül zweiwertig ist: Der Index 2 gibt an, dass zwei Wasserstoffatome assoziiert sind.
- Um die Anzahl der Wasserstoffatome rechts zu erhalten, multiplizieren Sie den Koeffizienten 4 mit dem Index 2 oder 8 Atomen.
- Was die Sauerstoffatome anbelangt, so gibt es auf der rechten Seite jetzt 6, die von den drei Molekülen von 3CO stammen2 (3 x 2 = 6 Atome) und 4 aus den 4 Molekülen von 4 H2O (4 x 1 = 4 Atome), dh insgesamt 10 Atome Sauerstoff.
-
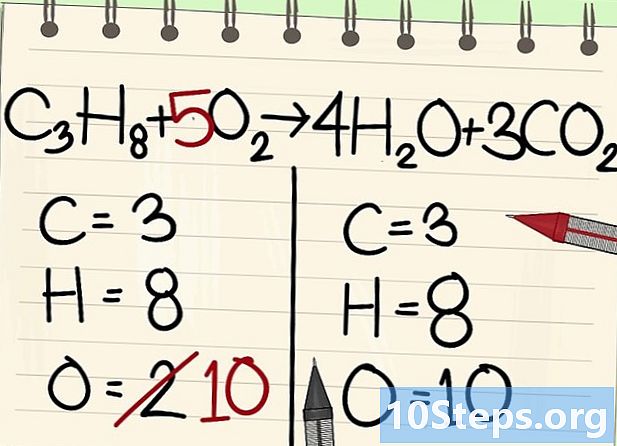
Gleichen Sie die Sauerstoffatome aus.- Aufgrund des Kohlenstoff- und Wasserstoffgleichgewichts ist die Anzahl der Sauerstoffatome auf beiden Seiten der Gleichung nicht gleich. Wir haben vorher gesehen, dass es rechts 10 Sauerstoffatome gibt (4 von Wassermolekülen und 6 von Kohlendioxidmolekülen). Auf der linken Seite gibt es nur 2 (von O2).
- Um den Sauerstoff auszugleichen, addieren Sie einen Koeffizienten von 5 zum linken Sauerstoffmolekül: Sie haben 10 Sauerstoffatome links und das andere rechts.
- C3H8 + 5O2 -> 4H2O + 3CO2
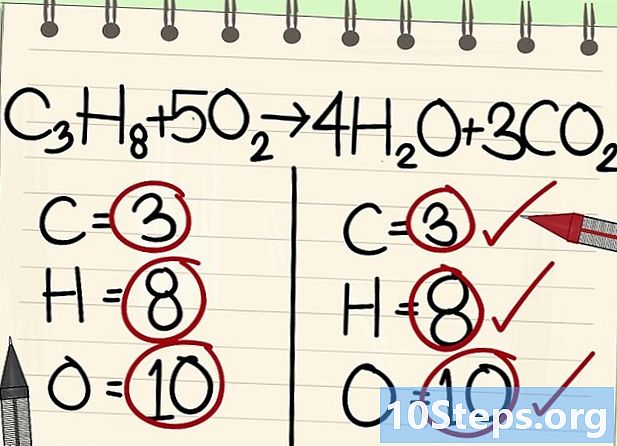
- Alle Atome (Kohlenstoff, Wasserstoff und Sauerstoff) sind ausgeglichen: Ihre Gleichung ist ausgeglichen.
Methode 2 Equilibrieren Sie eine Gleichung mit der algebraischen Methode
-

Schreiben Sie die Gleichung zum Ausbalancieren auf. Ordnen Sie jedem Molekül einen wörtlichen Koeffizienten zu. Wir werden sie anrufen hat, b, c und d. -
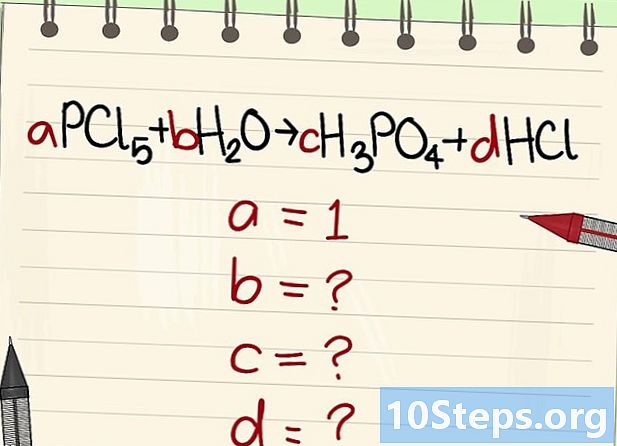
Ermitteln Sie den Wert der anderen Literalkoeffizienten. Wir werden das fragen hat = 1. -

Finden Sie die Beziehungen zwischen diesen Koeffizienten. Wenn Sie nach links (Reagenzien) und rechts (Produkte) schauen, stellen Sie die Beziehungen zwischen diesen verschiedenen Koeffizienten her.- Nehmen Sie die folgende Gleichung: aPCl5 + bH2O = cH3PO4 + dHCl. Es wurde angegeben, dass a = 1, was bedeutet, dass c = a, d = 5a und 2b = 3c + d. Berechnungen durchgeführt, c = 1, d = 5 und b = 4.

- Nehmen Sie die folgende Gleichung: aPCl5 + bH2O = cH3PO4 + dHCl. Es wurde angegeben, dass a = 1, was bedeutet, dass c = a, d = 5a und 2b = 3c + d. Berechnungen durchgeführt, c = 1, d = 5 und b = 4.


